Indonesia merupakan negara yang beriklim tropis dengan tingkat curah hujan dan kelembaban yang tinggi serta intensitas sinar matahari yang tinggi pula, dan sebagai negara berkembang, di Indonesia juga banyak bermunculan industri-industri yang mempunyai pengaruh cukup besar terhadap tingkat pencemaran pada lingkungan. Fenomena alam dan material khususnya logam mempunyai suatu keterikatan dalam suatu sistem dan proses.
Hubungan tersebut diimplementasikan dalam suatu proses kerusakan yang dinamakan korosi. Korosi adalah kerusakan material khususnya logam secara umum akibat reaksi dengan lingkungan sekitarnya. Korosi merupakan penurunaan kualitas yang disebabkan oleh reaksi kimia bahan logam dengan unsur-unsur lain yang terdapat di alam. Banyak contoh korosi disetitar lingkungan, seperti karat pada besi, noda pada perak, dan “platina” hijau yang terbentuk pada tembaga dan kuningan merupakan beberapa diantaranya. Berdasarkan uraian tersebut, akan dipaparkan lebih jelas terkait pengertian korosi, jenis – jenis korosi, faktor – faktor yang mempengaruhi laju korosi, dampak korosi serta metode pencegahan korosi.
Pengertian Korosi
Korosi berasal dari bahasa latin “Corrodere” yang artinya perusakan logam atau berkarat. Korosi dapat didefinisikan sebagai perusakan suatu material (terutama logam karena bereaksi dengan lingkungannya), karena bereaksi dengan lingkungannya, sebagian logam akan menjadi oksida, sulfida, atau hasil reaksi lain yang dapat larut dalam lingkungannya. Dengan bereaksi ini sebagian logam akan hilang menjadi suatu senyawa yang lebih stabil. Di alam logam pada umumnya berupa senyawa karena itu peristiwa korosi juga dapat dianggap sebagai peristiwa kembalinya logam menuju bentuk sebagaimana dia di alam. Dan ini merupakan kebalikan dari proses estractive metalurgy, yang memurnikan logam dari senyawanya. Dalam hal ini, korosi mengakibatkan kerugian karena hilangnya sebagian hasil usaha untuk memurnikan logam.
Pengertian lain dari korosi, yakni reaksi elektrokimia yang menyebabkan logam untuk berubah menjadi garam dan oksida. Serbuk ini terpisah dari logam dan menyebabkan struktur logam melemah dan kehilangan kekuatannya.Aksi elektrokimialah yang menyebabkan kekuatan struktur berkurang. Korosi merupakan proses alami dan ini hampir mungkin untuk dikendalikan. Pembersihan permukaan merupakan salah satu cara terbaik untuk mengendalikan korosi, saat kelembaban bersentuhan dengan permukaan logam, dengan pengumpulan kotoran maka disitulah akan terjadi korosi. Sebagai contoh rusaknya cat karet karena sinar matahari atau terkena bahan kimia, mencairnya lapisan tungku pembuatan baja, serangan logam yang solid oleh logam yang cair (liquid metal corrosion).
Jenis – jenis Korosi
Kebanyakan logam ada secara alami sebagai bijih-bijih yang stabil dari oksida-oksida, karbonat atau sulfida. Diperlukan energi untuk mengubah bijih logam menjadi sesuatu yang bermanfaat. Korosi hanyalah perjalanan sifat pembalikan satu proses yang tidak wajar kembali kepada suatu keadaan tenaga yang lebih rendah.Secara umum, tipe dari korosi dapat diklasifikasikan sebagai berikut :
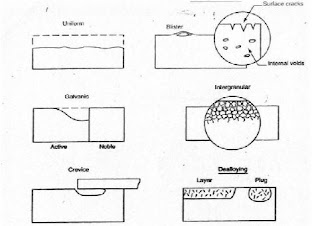
1. Korosi Seragam (Uniform Corrosion)
Korosi seragam merupakan korosi dengan serangan merata pada seluruh permukaan logam. Korosi terjadi pada permukaan logam yang terekspos pada lingkungan korosif.
2. Korosi Galvanik
Korosi galvanik terjadi jika dua logam yang berbeda tersambung melalui elektrolit sehingga salah satu dari logam tersebut akan terserang korosi sedang lainnya terlindungi dari korosi. Untuk memprediksi logam yang terkorosi pada korosi galvanic dapat dilihat pada deret galvanik.
3. Korosi Celah
Mirip dengan korosi galvanik, dengan pengecualian pada perbedaan konsentrasi media korosifnya. Celah atau ketidak teraturan permukaan lainnya seperti celah paku keling ( rivet ), baut, washer, gasket, deposit dan sebagainya, yang bersentuhan dengan media korosif dapat menyebabkan korosi terlokalisasi.
4. Korosi Sumuran
Korosi sumuran terjadi karena adanya serangan korosi lokal pada permukaan logam sehingga membentuk cekungan atau lubang pada permukaan logam. Korosi logam pada baja tahan karat terjadi karena rusaknya lapisan pelindung (passive film).
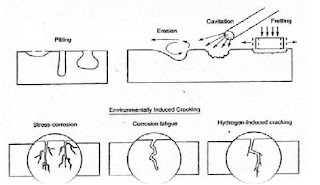
5. Retak Pengaruh Lingkungan (environmentally induced cracking)
Retak Pengaruh Lingkungan (environmentally induced cracking) merupakan patah getas dari logam paduan ulet yang beroperasi di lingkungan yang menyebabkan terjadinya korosi seragam. Ada tiga jenis tipe perpatahan pada kelompok ini, yaitu : stress corrosioncracking (SSC), corrosion fatigue cracking (CFC), dan hydrogen-induced cracking (HIC).
6. Kerusakan Akibat Hidrogen (Hidrogen damage)
Kerusakan ini disebabkan karena serangan hydrogen yaitu reaksi antara hydrogen dengan karbida pada baja dan membentuk metana sehingga menyebabkan terjadinya dekarburasi, rongga, atau retak pada permukaan logam. Pada logam reaktif seperti titanium, magnesium, zirconium dan vanadium, terbentuknya hidrida menyebabkan terjadinya penggetasan pada logam.
7. Korosi Batas Butir (intergranular corrosion)
Korosi yang menyerang pada batas butir akibat adanya segregasi dari unsur pasif seperti krom meninggalkan batas butir sehingga pada batas butir bersifat anodic.
8. Dealloying
Dealloying adalah lepasnya unsur – unsur paduan yang lebih aktif (anodik) dari logam paduan, sebagai contoh : lepasnya unsur seng atau Zn pada kuningan (Cu – Zn) dan dikenal dengan istilah densification.
9. Korosi Erosi
Korosi erosi disebabkan oleh kombinasi fluida korosif dan kecepatan aliran yang tinggi. Bagian fluida yang kecepatan alirannya rendah akan mengalami laju korosi rendah, sedangkan fluida kecepatan tinggi menyebabkan terjadinya erosi dan dapat menggerus lapisan pelindung sehingga mempercepat korosi.
10. Korosi Aliran (Flow induced Corrosion)
Korosi Aliran digambarkan sebagai effek dari aliran terhadap terjadinya korosi. Meskipun mirip, antara korosi aliran dan korosi erosi adalah dua hal yang berbeda. Korosi aliran adalah peningkatan laju korosi yang disebabkan oleh turbulensi fluida dan perpindahan massa akibat dari aliran fluida diatas permukaan logam. Korosi erosi adalah naiknya korosi dikarenakan benturan secara fisik pada permukaan oleh partikel yang terbawa fluida. Untuk lebih jelasnya jenis – jenis korosi dapat dilihat pada Gambar 1.
Gambar 1. Jenis – jenis Korosi (Jones,1991)
Proses Terjadinya Korosi
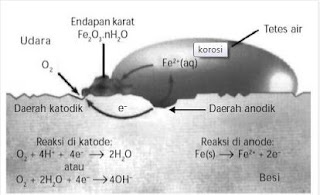
Pada bagian ini akan dijelaskan mekanisme terjadinya korosi pada besi. Oleh karena besi merupakan bahan utama untuk berbagai konstruksi maka pengendalian korosi menjadi sangat penting. Untuk dapat mengendalikan korosi tentu harus memahami bagaimana mekanisme korosi pada besi. Korosi tergolong proses elektrokimia, seperti yang ditunjukkan pada Gambar 2.
(Sumber : Chemistry : The Central Science,2000)
Gambar 2. Proses Korosi Pada Besi
Besi memiliki permukaan tidak halus akibat komposisi yang tidak sempurna, juga akibat perbedaan tegangan permukaan yang menimbulkan potensial pada daerah tertentu lebih tinggi dari daerah lainnya. Pada daerah anodik (daerah permukaan yang bersentuhan dengan air) terjadi pelarutan atom-atom besi disertai pelepasan elektron membentuk ion Fe2+ yang larut dalam air.
Fe(s) → Fe2+(aq) + 2e–
Elektron yang dilepaskan mengalir melalui besi, sebagaimana elektron mengalir melalui rangkaian luar pada sel volta menuju daerah katodik hingga terjadi reduksi gas oksigen dari udara.
O2(g) + 2H2O(g) + 2e– → 4OH–(aq)
Ion Fe2+ yang larut dalam tetesan air bergerak menuju daerah katodik, sebagaimana ion-ion melewati jembatan garam dalam sel volta dan bereaksi dengan ion-ion OH– membentuk Fe(OH)2. Fe(OH)2 yang terbentuk dioksidasi oleh oksigen membentuk karat.
2Fe2+(aq) + 4OH–(aq) → 2Fe(OH)2(s)
2Fe(OH)2(s) + O2(g) → Fe2O3.nH2O(s)
Reaksi keseluruhan pada korosi besi adalah sebagai berikut (lihat mekanisme pada Gambar 2) :
4Fe(s) + 3O2(g) + n H2O(l)
|
→
|
2Fe2O3.nH2O(s)
|
Karat
|
Akibat adanya migrasi ion dan elektron, karat sering terbentuk pada daerah yang agak jauh dari permukaan besi yang terkorosi (lubang). Warna pada karat beragam mulai dari warna kuning hingga cokelat merah bahkan sampai berwarna hitam. Warna ini bergantung pada jumlah molekul H2O yang terikat pada karat.
Gambar 3. Mekanisme Korosi Pada Besi
Emas dengan potensial reduksi standar 1,5 V lebih besar dibandingkan potensial reduksi standar gas O2 (1,23 V) sehingga emas tidak terkorosi di udara terbuka. Di alam emas terdapat sebagai logam murni.
Faktor yang Mempengaruhi Laju Korosi
Umumnya problem korosi disebabkan oleh air, tetapi ada beberapa faktor selain air yang mempengaruhi laju korosi, diantaranya:
1. Faktor Gas Terlarut.
§ Oksigen (O2), adanya oksigen yang terlarut akan menyebabkan korosi pada metal seperti laju korosi pada mild stell alloys akan bertambah dengan meningkatnya kandungan oksigen. Reaksi korosi secara umum pada besi karena adanya kelarutan oksigen adalah sebagai berikut :
Reaksi Anoda : Fe à Fe2+ + 2e
Reaksi katoda : O2 + 2H2O + 4e à 4 OH
§ Karbondioksida (CO2), jika karbon dioksida dilarutkan dalam air maka akan terbentuk asam karbonat (H2CO3) yang dapat menurunkan pH air dan meningkatkan korosifitas, biasanya bentuk korosinya berupa pitting yang secara umum reaksinya adalah:
CO2 + H2O à H2CO3
Fe + H2CO3 à FeCO3+H2
2. Faktor Temperatur
Penambahan temperatur umumnya menambah laju korosi walaupun kenyataannya kelarutan oksigen berkurang dengan meningkatnya temperatur. Apabila metal pada temperatur yang tidak uniform, maka akan besar kemungkinan terbentuk korosi.
3. Faktor pH
pH netral adalah 7, sedangkan ph < 7 bersifat asam dan korosif, sedangkan untuk pH > 7 bersifat basa juga korosif. Tetapi untuk besi, laju korosi rendah pada pH antara 7 sampai 13. Laju korosi akan meningkat pada pH < 7 dan pada pH > 13.
4. Faktor Bakteri Pereduksi atau Sulfat
Reducing Bacteria (SRB), Adanya bakteri pereduksi sulfat akan mereduksi ion sulfat menjadi gas H2S, yang mana jika gas tersebut kontak dengan besi akan menyebabkan terjadinya korosi.
5. Faktor Padatan Terlarut
§ Klorida (Cl), klorida menyerang lapisan mild steel dan lapisan stainless steel. Padatan ini menyebabkan terjadinya pitting, crevice corrosion, dan juga menyebabkan pecahnya alooys.
§ Karbonat (CO3), kalsium karbonat sering digunakan sebagai pengontrol korosi dimana film karbonat diendapkan sebagai lapisan pelindung permukaan metal, tetapi dalam produksi minyak hal ini cenderung menimbulkan masalah scale.
§ Sulfat (SO4), ion sulfat ini biasanya terdapat dalam minyak. Dalam air, ion sulfat juga ditemukan dalam konsentrasi yang cukup tinggi dan bersifat kontaminan, dan oleh bakteri SRB sulfat diubah menjadi sulfide yang korosif.
Dampak Korosi
Korosi yang terjadi pada logam tidak dapat dihindari, tetapi hanya dapat dicegah dan dikendalikan sehingga struktur atau komponen mempunyai masa pakai yang lebih lama. Setiap komponen atau struktur mengalami tiga tahapan utama yaitu perancangan, pembuatan dan pemakaian. Ketidakberhasilan salah satu aspek seperti korosi menyebabkan komponen akan mengalami kegagalan. Kerugian yang akan dialami dengan adanya korosi meliputi finansial dan safety, diantaranya :
§ Penurunan kekuatan material
§ Penipisan
§ Downtime dari equipment
§ Retak & Pitting
§ Kebocoran fluida
§ Embrittlement
§ Penurunan sifat permukaan material
§ Penurunan nilai / hasil produksi
§ Modification
Adapun dampak korosi bagi kehidupan :
1. Kerugian Ekonomi Akibat Korosi
Korosi juga menjadi masalah ekonomi karena menyangkut umur, penyusutan dan efisiensi pemakaian suatu bahan maupun peralatan dalam kegiatan industri. Milyaran Dolar AS telah dibelanjakan setiap tahunnya untuk merawat jembatan, peralatan perkantoran, kendaraan bermotor, mesin-mesin industri serta peralatan elektronik lainnya agar umur konstruksinya dapat bertahan lebih lama. Kerugian yang dapat ditimbulkan oleh korosi tidak hanya biaya langsung seperti pergantian peralatan industri, perawatan jembatan, konstruksi dan sebagainya, tetapi juga biaya tidak langsung seperti terganggunya proses produksi dalam industri serta kelancaran transportasi yang umumnya lebih besar dibandingkan biaya langsung.
Contoh korosi yang menyebabkan kerugian ekonomi dalam kehidupan sehari-hari misalnya : Korosi pada atap rumah yang terbuat dari seng. Seng merupakan salah satu bahan yang digunakan pada bangunan yaitu untuk penutup atap. Seng untuk atap ini banyak di dapatkan di toko bangunan. Proses Awal yaitu mula terjadinya korosi pada atap rumah. Proses awal ini korosi yang terjadi masih sedekit sekali dan belum terlihat dengan terlalu jelas. Setelah korosi mulai tampak pada atap rumah jika tidak segera dilakukan perlindungan maka korosi lambat laun akan menyebar dan penyebaran pada proses korosi kedua pada atap rumah. ada tahap ketiga penyebaran korosi semakin meluas dan mengkorosi hampir pada seluruh bagian lembaran seng.
2. Pemborosan Sumber Daya Alam
Dengan adanya proses korosi pada struktur bangunan di tempat-tempat yang tersebar di seluruh dunia, mengakibatkan sumber daya mineral yang semula berbentuk logam teknis telah berubah menjadi produk korosi yang tersebar tanpa bisa didaur ulang untuk dijadikan logam teknis kembali.
3. Korosi Dapat Membahayakan Jiwa Manusia
Korosi yang dapat membahayakan jiwa manusia contohnya yaitu: kebocoran saluran pipa pada minyak. Pipa-pipa yang dibungkus isolator panas juga bisa mengalami masalah korosi karena sel aerasi-differensial yang terbentuk di balik/ di bawah isolasi. Isolator yang terbuat dari bahan penghambat perambatan panas juga berfungsi sebagai sumbu yang merembeskan air ke bagian lain. Korosi di bawah isolasi digolongkan sebagai korosi atmosferik dengan faktor penyebab air. Air yang mungkin berasal dari hujan, kabut, atau pengembunan akibat kelembaban relatif tinggi. Korosi yang dibiarkan terus menerus bukan tidak mungkin mengakibatkan terjadinya kebocoran. Kebocoran semacam ini tentu sangat dihindari oleh perusahaan besar yang tidak ingin menelan kerugian. Korosi yang menyebabkan kebocoran pada pipa minyak dapat merembes ke saluran air sumur masyarakat sehingga minyak dapat mencemari saluran air sumur dan dapat membahayakan kehidupan
Metode Pencegahan Korosi
Dengan dasar pengetahuan tentang proses korosi yang dapat menjelaskan mekanisme dari korosi, dapat dilakukan usaha-usaha untuk pencegahan terbentuknya korosi.
1. Pengubahan Media
Korosi merupakan interaksi antara logam dengan media sekitarnya, maka pengubahan media sekitarnya akan dapat mengubah laju korosi. Ada tiga situasi yang dapat terjadi yaitu:
§ Media sekitar / lingkungan berupa gas
§ Media sekitar berupa larutan dengan ion-ion tertentu
§ Logam terbenam dalam tanah.
2. Seleksi Material
Metode umum yang sering digunakan dalam pencegahan korosi yaitu pemilihan logam atau paduan dalam suatu lingkungan korosif tertentu untuk mengurangi resiko terjadinya korosi.
3. Proteksi Katodik (Cathodic Protection)
Besi yang dilapisi atau dihubugkan dengan logam lain yang lebih aktif akan membentuk sel elektrokimia dengan besi sebagai katoda. Di sini, besi berfungsi hanya sebagai tempat terjadinya reduksi oksigen. Logam lain berperan sebagai anoda, dan mengalami reaksi oksidasi. Dalam hal ini besi, sebagai katoda, terlindungi oleh logam lain (sebagai anoda, dikorbankan). Besi akan aman terlindungi selama logam pelindungnya masih ada / belum habis. Untuk perlindungan katoda pada sistem jaringan pipa bawah tanah lazim digunakan logam magnesium, Mg. Logam ini secara berkala harus dikontrol dan diganti.
4. Proteksi Anodik (Anodic Protection)
Adanya arus anodik akan meningkatkan laju ketikteraturan logam dan menurunkan laju pembentukan hidrogen. Hal ini bisa terjadi untuk logam – logam “Active – Passive” seperti Ni, Fe, Cr, Ti, dan paduannya. Jika arus yang lewat logam dikontrol seksama (dengan potentiostat) maka logam akan bersifat pasif dan pembentukan logam – logam tak terlarut akan berkurang.
5. Inhibitor Korosi
Salah satu cara yang dapat dilakukan untuk mencegah terjadinya korosi adalah dengan penggunaan inhibitor korosi. Secara umum suatu inhibitor adalah suatu zat kimia yang dapat menghambat atau memperlambat suatu reaksi kimia. Sedangkan inhibitor korosi adalah suatu zat kimia yang bila ditambahkan kedalam suatu lingkungan, dapat menurunkan laju penyerangan korosi lingkungan itu terhadap suatu logam. Mekanisma penghambatannya terkadang lebih dari satu jenis. Sejumlah inhibitor menghambat korosi melalui cara adsorpsi untuk membentuk suatu lapisan tipis yang tidak nampak dengan ketebalan beberapa molekul saja, ada pula yang karena pengaruh lingkungan membentuk endapan yang nampak dan melindungi logam dari serangan yang mengkorosi logamnya dan menghasilkan produk yang membentuk lapisan pasif, dan ada pula yang menghilangkan konstituen yang agresif.
6. Pelapisan (Coatings)
Prinsip umum dari pelapisan yaitu melapiskan logam induk dengan suatu bahan atau material pelindung. Jenis - jenis coating :
§ Metallic coatings
§ Paint /organic coatings
§ Chemical conversion coatings
§ Miscellaneous coatings (enamel, thermoplastics)
Selain itu terdapat cara-cara umum untuk mencegah korosi.
1. Pengecatan. Jembatan, pagar, dan railing biasanya dicat. Cat menghindarkan kontak dengan udara dan air. Cat yang mengandung timbel dan zink (seng) akan lebih baik, karena keduanya melindungi besi terhadap korosi.
2. Pelumuran dengan Oli atau Gemuk. Cara ini diterapkan untuk berbagai perkakas dan mesin. Oli dan gemuk mencegah kontak dengan air.
3. Pembalutan dengan Plastik. Berbagai macam barang, misalnya rak piring dan keranjang sepeda dibalut dengan plastik. Plastik mencegah kontak dengan udara dan air.
4. Tin Plating (pelapisan dengan timah). Kaleng-kaleng kemasan terbuat dari besi yang dilapisi dengan timah. Pelapisan dilakukan secara elektrolisis, yang disebut tin plating. Timah tergolong logam yang tahan karat. Akan tetapi, lapisan timah hanya melindungi besi selama lapisan itu utuh (tanpa cacat). Apabila lapisan timah ada yang rusak, misalnya tergores, maka timah justru mendorong/mempercepat korosi besi. Hal itu terjadi karena potensial reduksi besi lebih negatif daripada timah. Oleh karena itu, besi yang dilapisi dengan timah akan membentuk suatu sel elektrokimia dengan besi sebagai anode. Dengan demikian, timah mendorong korosi besi. Akan tetapi hal ini justru yang diharapkan, sehingga kaleng-kaleng bekas cepat hancur.
5. Galvanisasi (pelapisan dengan Zink). Pipa besi, tiang telepon dan berbagai barang lain dilapisi dengan zink. Berbeda dengan timah, zink dapat melindungi besi dari korosi sekalipun lapisannya tidak utuh. Hal ini terjadi karena suatu mekanisme yang disebut perlindungan katode. Oleh karena potensial reduksi besi lebih positif daripada zink, maka besi yang kontak dengan zink akan membentuk sel elektrokimia dengan besi sebagai katode. Dengan demikian besi terlindungi dan zink yang mengalami oksidasi (berkarat). Badan mobil-mobil baru pada umumnya telah digalvanisasi, sehingga tahan karat.
6. Cromium Plating (pelapisan dengan kromium). Besi atau baja juga dapat dilapisi dengan kromium untuk memberi lapisan pelindung yang mengkilap, misalnya untuk bumper mobil. Cromium plating juga dilakukan dengan elektrolisis. Sama seperti zink, kromium dapat memberi perlindungan sekalipun lapisan kromium itu ada yang rusak.
7. Sacrificial Protection (pengorbanan anode). Magnesium adalah logam yang jauh lebih aktif (berarti lebih mudah berkarat) daripada besi. Jika logam magnesium dikontakkan dengan besi, maka magnesium itu akan berkarat tetapi besi tidak. Cara ini digunakan untuk melindungi pipa baja yang ditanam dalam tanah atau badan kapal laut. Secara periodik, batang magnesium harus diganti.
Dua jenis mekanisma utama dari korosi adalah berdasarkan reaksi kimia secara langsung, dan reaksi elektrokimia. Korosi dapat terjadi didalam lingkungan kering dan juga lingkungan basah. Korosi yang terjadi pada logam tidak dapat dihindari, tetapi hanya dapat dicegah dan dikendalikan sehingga struktur atau komponen mempunyai masa pakai yang lebih lama. Hasil dari proses kerusakan berupa berbagai produk korosi misalnya berbagai macam oksida logam, kerusakan permukaan logam secara morfologi, perubahaan sifat mekanis, perubahan sifat kimia. Dengan dasar pengetahuan tentang elektrokimia proses korosi yang dapat menjelaskan mekanisme dari korosi, dapat dilakukan usaha-usaha untuk pencegahan terbentuknya korosi.
DAFTAR PUSTAKA
Chang, R., (2002). Chemistry. Edisi Ketiga Jilid 2, Boston: McGraw-Hill Companies. Inc.
Dalimunthe, I.S. 2004. Kimia Dari Inhibitor Korosi. Universitas Sumatra Utara.
Jones, D.A. 1991. Principle and Prevention of Corrosion. New York : Mc. Millan Publishing Company.
Maulana, P. 2013. Pengertian Korosi, Penyebab dan Pencegahannya. http://perpustakaancyber.blogspot.com/2013/07/pengertian-korosi-penyebab-cara-pencegahan.html. (Diakses pada tanggal 24 November 2014).
Suardana, I Nyoman dan I Nyoman Retug.2003.Kimia Fisika III. Singaraja: Jurusan Pendidikan Kimia, Fakultas MIPA, IKIP Negeri Singaraja.
Sugito,P. 2013. Korosi dan Pencegannya. http://putrasugito90.blogspot.com/2013/04/korosi-dan-pencegahannya.html.(Diakses pada tanggal 24 November 2014).
Trethewey, K. R., & Chamberlain, J. 1991.Korosi Untuk Mahasiswa Sains dan Rekayasa. Jakarta : PT. Gramedia Pustaka Utama.
Widharto, S. 2001. Karat dan Pencegahannya. Jakarta : P.T. Pradnya Paramita.
Download versi PDF: Klik Disini

Apabila Anda mempunyai kesulitan dalam pemakaian / penggunaan chemical , atau yang berhubungan dengan chemical, jangan sungkan untuk menghubungi, kami akan memberikan konsultasi kepada Anda mengenai masalah yang berhubungan dengan chemical.
ReplyDeleteSalam,
(Tommy.k)
WA:081310849918
Email: Tommy.transcal@gmail.com
Management
OUR SERVICE
Boiler Chemical Cleaning
Cooling tower Chemical Cleaning
Chiller Chemical Cleaning
AHU, Condensor Chemical Cleaning
Chemical Maintenance
Waste Water Treatment Plant Industrial & Domestic (WTP/WWTP/STP)
Degreaser & Floor Cleaner Plant
Oli industri
Rust remover
Anti karat